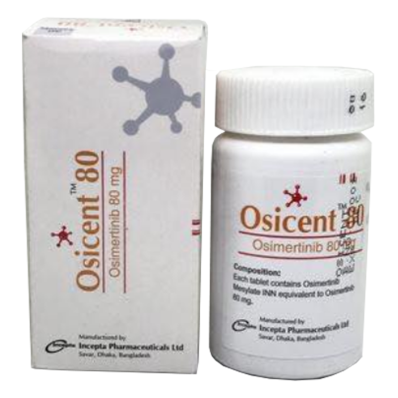


商品名: Osimertinib 奥西替尼 AZD9291
Goods name: Osimertinib
通用名: 奥西替尼 AZD9291
Generic name: Osimertinib
制造商: 孟加拉国(Bengal)|Incepta
Manufacturer: Bengal|Incepta
形式: 30片/盒 80mg
Form: 30 pieces / box 80mg
贮存: 常温
Keep in storage: homoeothermy
品牌(Brand): INCEPTA
积分(integral): 83
分销积分(distribution integral): 34
以下资料仅供参考
请仔细阅读说明书并在医师指导下使用:甲磺酸奥希替尼片说明书
美国FDA首次批准:2015
【药品名称】
通用名称:甲磺酸奥希替尼片
商品名称:Oscient
通用英文名称:Osimertinib Mesylate
其他名称:泰瑞沙
[成份】
本品活性成份为甲磺酸奥希替尼
化学名称:N-{2-{[2-(二甲氨基)乙基](甲基)氨基}-4-甲氧基-5-{[4-(l-甲基-lH-吲 哚-3-基)嘧啶-2-基]氨基}苯基)丙-2 烯酰胺甲磺酸盐
分子式: C28H33N7O2 . CH4O3S
分子量: 595.71
【规格】80mg/片*30片/瓶
【适应症/功能主治】
适用于既往经表皮生长因子受体(EGFR)酪氨酸激酶抑制剂(TKI)治疗时或治疗后出现疾病进展,并且经检测确认存在 EGFR T790M 突变阳性的局部晚期或转移性非小细胞性肺癌(NSCLC)成人患者的治疗。
【用法用量】
在使用本品治疗局部晚期或转移性 NSCLC 前,首先需要明确 EGFR T790M 突变的状态。应采用经过充分验证的检测方法确定存在 EGFR T790M 突变方可使用本品治疗(详见【注意事项】)。
剂量
本品的推荐剂量为每日 80mg,直至疾病进展或出现无法耐受的毒性。
如果漏服本品 1 次,则应补服本品,除非下次服药时间在 12 小时以内。
本品应在每日相同的时间服用,进餐或空腹时服用均可。
剂量调整
根据患者个体的安全性和耐受性,可暂停用药或减量。如果需要减量,则剂量应减至 40mg,每日 1 次。
出现不良事件(AE)和毒性后的减量原则请见表 1。
表 1. 出现不良事件后甲磺酸奥希替尼片的剂量调整原则
靶器官 | 不良事件 a | 剂量调整 |
肺 | 间质性肺病/非感染性肺炎 | 永久停用本品 |
心脏 | 至少两次单独的心电图检测提示 QTc间期大于500ms | 暂停使用本品,直至 QTc 间期小于 481ms 或恢复到基线水平(如基线值大于或等于 481ms)采用 40mg 剂量重新开始用药 |
QTc 间期延长,并出现严重心律失常的症状或体征 | 永久停用本品 | |
无症状性的左心室射血分数(LVEF) 绝对值相对基线下降 10%并低于 50% | 暂停本品治疗最多 4 周。 • 如果改善至基线 LVEF 水平,重新开始治疗。 • 如果未改善至基线水平,永久性终止治疗。 | |
症状性充血性心力衰竭 | 永久性中止本品治疗。 | |
其它 | 3 级或以上不良反应 | 暂停使用本品,最多可达 3 周 |
如果暂停本品用药达 3 周后,3 级或以上的不良反应已改善至 0-2 级 | 则可按原剂量(80mg)或减量(40mg)复用本品。 | |
如果暂停本品用药达 3 周后,3 级或以上的不良反应未下降至 0-2 级 | 永久停用本品 |
a注:根据美国《国家癌症研究院(NCI)不良事件通用术语标准》(CTCAE)第 4.0 版对临床不良事件的强度进行了分级。
QTc:通过心率校正的 QT 间期
特殊人群
无需因为患者的年龄、体重、性别、种族和吸烟状态对剂量进行调整(见【药代动力学】)。
肝功能损害
轻度肝功能损害(总胆红素<正常值上限(ULN)且谷草转氨酶(AST)达1至 1.5xULN;或总胆红素达1至1.5xULN,AST不限)患者无需进行剂量调整,但此类患者仍应慎用本品。中重度肝功能损害患者使用本品的安全性和有效性尚不明确。
在获得更多信息前,不建议中重度肝功能损害患者使用本品。 (见【药代动力学】)。
肾功能损害
轻中度肾功能损害患者使用本品时无需进行剂量调整。重度肾功能损害患者使用本品的数据有限。终末期肾病(经 Cockcroft 和 Gault 方程计算的肌酐清除率(CLcr)<15mL/min)或正在接受透析的患者使用本品的安全性和有效性尚不明确。
患有重度或终末期肾功能损害的患者应慎用本品 (见【药代动力学】)。
给药方法
本品为口服使用。本品应整片和水送服,不应压碎、掰断或咀嚼。
如果患者无法吞咽药物,则可将药片溶于 50mL 不含碳酸盐的水中。应将药片投入水中,无需压碎,直接搅拌至分散后迅速吞服。随后应再加入半杯水,以保证杯内无残留,随后迅速饮用。不应添加其它液体。
需要经胃管喂饲时,可采用和上述相同的方式进行处理,只是最初溶解药物时用水 15mL,后续残余物冲洗时用水 15mL。这 30mL 液体均应按鼻胃管生产商的说明进行喂饲,同时用适量的水冲洗。这些溶解液和残余液均应在将药片加入水中后 30 分钟内服用。
【不良反应】
安全性数据总结(不考虑因果关系)
在两项全球单臂临床试验中(AURA 扩展研究 II 期部分和 AURA 2 研究)获得了 411名既往接受过治疗的T790M突变阳性的NSCLC患者使用本品的安全性数据,这些患者服用的剂量为每日 80mg。411 例患者中,333 例暴露于本品治疗至少 6 个月;97 例患者暴露至少 9 个月;但是,无患者暴露达 12 个月。
本品治疗组患者中最常见(>20%)不良事件为腹泻(42%)、皮疹(41%)、皮肤干燥(31%)和指(趾)甲毒性(25%)。
导致剂量减少或中断治疗的最常见不良事件为心电图 QTc 间期延长(2.2%)和中性粒细胞减少(1.9%)。2%或2%以上患者报告的严重不良事件为肺炎和肺栓塞。本品治疗组 4 例患者(1%)出现致死性间质性肺病/非感染性肺炎不良事件。1 例以上患者报告的其它致死性不良事件包括感染性肺炎(4 例患者)和心脑血管意外/脑出血(2 例患者)。本品治疗组 5.6%患者因不良事件而中止治疗。导致中止治疗的最常见不良事件为间质性肺病/非感染性肺炎和脑血管意外/脑梗死。
表 2 两项全球单臂研究中发生率>10%的所有 NCICTCAE*级别的不良事件及发生率>2%的 NCI CTCAE* 3-4 级不良事件
不良事件 | 奥希替尼 N=411 | |
所有级别 | 3~4 级 f | |
% | % | |
胃肠道疾病 | ||
腹泻 | 42 | 1.0 |
恶心 | 17 | 0.5 |
纳差 | 16 | 0.7 |
便秘 | 15 | 0.2 |
口腔炎 | 12 | 0 |
皮肤病 | ||
皮疹 a | 41 | 0.5 |
皮肤干燥 b | 31 | 0 |
指(趾)甲毒性 c | 25 | 0 |
瘙痒 | 14 | 0 |
眼病 d | 18 | 0.2 |
呼吸系统疾病 | ||
咳嗽 | 14 | 0.2 |
全身性疾病 | ||
疲劳 | 14 | 0.5 |
肌肉骨骼系统疾病 | ||
背痛 | 13 | 0.7 |
中枢神经系统疾病 | ||
头痛 | 10 | 0.2 |
感染 | ||
感染性肺炎 | 4 | 2.2 |
血管事件 | ||
静脉血栓栓塞 e | 7 | 2.4 |
* NCI CTCAE v4.0。
a. 包括下列皮疹类归类术语的报告病例:皮疹、全身性皮疹、红斑疹、斑疹、斑丘疹、丘疹、脓疱性皮疹、红斑、毛囊炎、痤疮、皮炎和痤疮样皮炎。 b. 包括皮肤干燥、湿疹、皮肤裂纹、干燥病。
c. 包括下列归类术语的报告病例:甲床疾病、甲床炎症、甲床触痛、甲床变色、指(趾)甲疾病、指(趾)甲毒性甲、指(趾)甲萎缩、指(趾)甲感染、指(趾)甲硬化、脆甲、甲脱离、脱甲、甲沟炎。
d. 包括干眼、视力模糊、角膜炎、白内障、眼刺激、眼睑炎、眼痛、流泪增加、飞蚊症。出现其它眼科毒性的患者<1%。
e. 包括深静脉血栓形成、颈内静脉血栓形成和肺栓塞。
f. 未报告 4 级事件。
安全性数据总结(明确为药物不良反应的部分)
表 3 列举了服用本品的患者中常见的药物不良反应(ADR)发生率。
不良反应根据 MedDRA 的系统器官分类(SOC)进行列表。在每个系统器官分类内部按发生频率对 ADR 进行了排列,其中频率最高的 ADR 居首。在每个频率类别内则按严重程度的降序对 ADR 进行排列。此外,依据 CIOMS III 的常规概念对每项 ADR 相应的发生频率进行了归类,这些发生频率的类别为:极常见(≥1/10);常见(>1/100 至<1/10);少见(≥1/1,000 至<1/100);罕见(≥1/10,000 至<1/1,000);极罕见(<1/10,000);不详(根据现有数据无法估计)。本节仅纳入了已经结束的研究获得的数据,在这些研究中,患者的暴露量是已知的。
表 3. AURAa 研究期间报告的药物不良反应
表 3. AURAa研究期间报告的药物不良反应
MedDRA SOC | MedDRA 术语 | CIOMS 分类/总体频率 (所有 CTCAE 分级)b | 3-4 级 CTCAE 的频率 |
呼吸、胸部及纵膈系统疾病 | 间质性肺病 c | 常见 (2.7%)d
| 0.7% |
胃肠道疾病 | 腹泻 | 极常见 (42%) | 1% |
口腔炎 | 极常见 (12%) | 0% | |
皮肤及皮下组织疾病
| 皮疹 e | 极常见 (41%)
| 0.5% |
皮肤干燥 f | 极常见 (31%)
| 0% | |
甲沟炎 g | 极常见 (25%) | 0% | |
瘙痒 h | 极常见 (14%) | 0% | |
实验室检查(依据检验结果确定,并按 CTCAE 级别的变化情况给出) | QT 间期延长 i | 少见(0.2%) | |
血小板计数下降 j | 极常见 (54%) | 1.2% | |
白细胞减少 j | 极常见 (67%) | 1.2%
| |
中性粒细胞减少 j | 极常见 (33%) | 3.4% | |
a 表中所列的数据均为 AURA 扩展研究(AURA ex; II 期)和 AURA 2 研究中累积获得的数据;仅对至少服用了
1 次本品的患者所发生的不良事件进行了总结。
b 美国国家癌症研究院不良事件通用术语标准(NCI CTCAE)第 4.0 版。
c 包括下列归类术语的报告病例:间质性肺炎和非感染性肺炎。
d 共有 4 例 CTCAE 5 级事件(致死性事件)报告。
e 包括了下列皮疹类事件的归类术语的报告病例:皮疹、泛发型皮疹、红色斑疹、斑疹、斑丘疹、丘疹、脓疱疹、红斑、毛囊炎、痤疮、皮炎和痤疮样皮炎。
f 包括下列归类术语的报告病例:皮肤干燥、皮肤皲裂、干燥病、湿疹。
g 包括下列归类术语的报告病例:甲床疾病、甲床炎症、甲床触痛、甲床变色、指(趾)甲疾病、指(趾)甲毒性、指(趾)甲萎缩、指(趾)甲感染、指(趾)甲硬化、脆甲、甲脱离、脱甲、甲沟炎。
h 包括下列归类术语的报告病例:瘙痒、全身性瘙痒、眼睑瘙痒。
i 表示 QTcF 延长 >500msec 的患者(心电图数据计算所得,并非已报告不良事件的发生率)。
j 表示实验室检查所见的发生率,并非已报告不良事件的发生率。
表示实验室检查所见的发生率,并非已报告不良事件的发生率。
AURA 17 安全性数据总结
在亚太地区 II 期研究(表 4. AURA 17,参见【临床试验】)中获得了 171 名(其中 148 名为中国患者)既往接受过治疗的 T790M 突变阳性的 NSCLC 患者使用本品的亚太人群安全性数据,这些患者服用的剂量为每日 80mg。AURA 17 的安全性数据与全球 II 期安全性数据一致。绝大多数不良反应的严重程度为 1 或 2 级。最常报告的 ADR 有:腹泻(29%)和皮疹(20%)。AURA 17 研究中,CTCAE 3 级以上不良事件的发生率为 14%。在以每日 80mg 的方案接受本品治疗的患者中,因 ADR 减量的患者占 0.6%。有 1.2% 的患者因为不良反应或实验室检查异常而提前停药。
表 4. AURA 17a研究期间报告的药物不良反应
MedDRA SOC | MedDRA 术语 | CIOMS 分类/总体频率 (所有 CTCAE 分级)b | 3-4 级 CTCAE 的频率 |
呼吸、胸部及纵膈系统疾病 | 间质性肺病 c | 常见 (1.8%)d
| 0% |
胃肠道疾病 | 腹泻 | 极常见 (29%) | 0% |
口腔炎 | 常见 (3.5%) | 0% | |
皮肤及皮下组织疾病
| 皮疹 e | 极常见 (20%)
| 0% |
皮肤干燥 f | 极常见 (17%)
| 0.6% | |
甲沟炎 g | 常见 (7.6%) | 0% | |
瘙痒 h | 极常见 (13%) | 0% | |
实验室检查(依据检验结果确定,并按 CTCAE 级别的变化情况给出) | QTc 间期延长 i | 十分罕见 (0%) | |
血小板计数下降 j | 极常见 (65%) | 1.2% | |
白细胞减少 j | 极常见 (67%) | 0%
| |
中性粒细胞减少 j | 极常见 (29%) | 1.2% |
a 表中所列的数据基于 AURA 17 研究的首次数据截止日期。在此节点,所有患者均有机会接受 18 周(4.5 个月)治疗;仅对至少服用了 1 次本品的患者所发生的不良事件进行了总结。
b 美国国家癌症研究院不良事件通用术语标准第 4.0 版。
c 包括下列归类术语的报告病例:间质性肺炎和非感染性肺炎。
d 共有 1 例 CTCAE 5 级事件(致死性事件)报告。
e 包括了下列皮疹类事件的归类术语的报告病例:皮疹、泛发型皮疹、红色斑疹、斑疹、斑丘疹、丘疹、脓疱疹、红斑、毛囊炎、痤疮、皮炎和痤疮样皮炎。
f 包括下列归类术语的报告病例:皮肤干燥、皮肤皲裂、干燥病、湿疹。
g 包括下列归类术语的报告病例:甲床疾病、甲床炎症、甲床触痛、甲床变色、指(趾)甲疾病、指(趾)甲毒性、指(趾)甲萎缩、指(趾)甲感染、指(趾)甲硬化、脆甲、甲脱离、脱甲、甲沟炎。
h 包括下列归类术语的报告病例:瘙痒、全身性瘙痒、眼睑瘙痒。
i 表示 QTcF >500msec 的患者(心电图数据计算所得,并非已报告不良事件的发生率)j 表示实验室检查所见的发生率,并非已报告不良事件的发生率。
特定药物不良反应的描述间质性肺病(ILD)
II 期研究期间,有 6.2%的日本裔患者出现了 ILD,而非日本裔亚裔患者和非亚裔患者的发生率分别为 1.2%和 2.4%。ILD 或 ILD 样不良反应发生的中位时间为
2.7 个月(见【注意事项】)。
QTc间期延长
AURAex和AURA2研究的411名患者中, 1名患者(0.2%)的QTc间期延长,并超过了 500ms,有 11 名患者(2.7%)的 QTc 间期较基线值延长了 60ms 以上。对本品进行的一项药代动力学分析预测,QTc 间期延长的发生率会出现浓度依赖性增加。AURAex 或 AURA2 研究期间无心律失常事件报告(见【注意事项】)。
心肌收缩力改变
AURAex 和 AURA2 研究中(N=411),具有基线和至少 1 次随访的 LVEF 评估的患者中 2.4%(9/375)发生左心室射血分数(LVEF)下降>10%,且下降至<50%。
老年患者
在临床研究期间服用奥希替尼的患者中(N=411),有 46%的年龄达 65 周岁或以上,有 13%的年龄在 75 周岁或以上。和年龄较轻的受试者(<65 岁)相比,年龄 ≥65 岁的受试者出现导致研究药物剂量调整(暂停用药或减量)的不良反应的人数更多(23% vs. 17%)。这两类患者。和年龄较轻的患者相比,老年患者出现的 3 级或以上的不良反应更多(32% vs. 28%)。
可疑不良反应的报告
药品获得批准后,报告可疑不良反应非常重要。此举能够保证对产品的风险获益平衡进行持续的监测。
【禁忌】
对本品成分过敏着禁用。
本品不得与圣约翰草一起服用(见【药物相互作用】)。
【注意事项】
EGFR T790M 突变状态的评价
当考虑使用本品治疗局部晚期或转移性NSCLC时,首先需要明确EGFR T790M突变的状态。应采用经过充分验证的检测方法对采自组织样本的肿瘤DNA 或血浆样本中获取的循环肿瘤DNA(ctDNA)进行检测。
在对肿瘤 DNA(通过组织或血浆样本)的 T790M 突变状态进行检测时,必须使用稳健、可靠和敏感的检测方法。
通过组织或血浆检测后,如果T790M突变为阳性,则提示可使用本品治疗。然而,如果使用的是血浆ctDNA检测,且结果为阴性,则在可能的情况下应再进行组织检测,这是由于血浆检测可能会出现假阴性的结果。
间质性肺病(ILD)
在临床研究中,在使用本品的患者曾观察到重度、危及生命或致死性的间质性肺病(ILD)或 ILD 样的不良反应(如非感染性肺炎)。暂停用药后,上述绝大多数事件均会改善或缓解。临床研究中排除了既往存在 ILD 病史、药物诱导性 ILD、需要
类固醇激素治疗的放射性肺炎及临床存在活动性 ILD 证据的患者(见【不良反应】)。
临床研究期间,在接受本品治疗的 1221 名患者中,有 2.9%的患者出现了间质性肺病(ILD)或 ILD 样的不良反应(如非感染性肺炎),其中有 0.3%的受试者死亡。
在两项 II 期研究期间,接受本品治疗的 411 名患者中有 11 名(2.7%)报告了 ILD 或 ILD 样不良反应,其中 3 或 4 级不良事件占 0.7%,有 1%的患者死亡。研究期间,有 6.2%的日本裔患者出现了 ILD,而亚裔患者和非亚裔患者的发生率分别为 1.2% 和 2.4% (见【不良反应】)。
仔细检查出现肺部症状(呼吸困难、咳嗽、发热)急性发作和/或不明原因加重的患者,排除 ILD。在对这些症状查找病因时,应暂停本品的用药。如果确诊为
ILD,则应永久停用本品,并采取必要的治疗措施。
QTc 间期延长
在服用本品的患者中出现过 QTc 间期延长。QTc 间期延长可导致室性快速性心律失常(如尖端扭转型室性心动过速)或猝死的风险增加。AURAex 或 AURA2 研究期间无心律失常事件报告(见【不良反应】)。通过静息心电图(ECG)检测,这两项研究排除了心脏节律或传导方面出现临床显著性异常的患者(如 QTc 间期>470ms) (见【不良反应】)。
如果可能,患有先天性长 QT 间期综合征的患者应避免使用本品。患有充血性心力衰竭、电解质异常或使用已知能够延长 QTc 间期的药物的患者应定期接受心电图(ECG)和电解质的监测。至少两次独立心电图检测提示 QTc 间期>500ms 的患者应暂时停用本品,直至 QTc 间期<481ms 或恢复至基线水平(如基线 QTc 间期>=481ms),此时可恢复用药,但应按表 1 进行减量。合并出现 QTc 间期延长和下列任何一种情况的患者需永久停用本品:尖端扭转性室性心动过速、多形性室性心动过速、严重性心律失常的症状或体征。
心肌收缩力改变
AURAex 和 AURA2 临床试验中,具有基线和至少 1 次随访的 LVEF 评估的接受奥希替尼治疗的患者中 2.4%(9/375)发生左心室射血分数(LVEF)下降>10%,且下降至<50%。根据已有临床试验数据,尚不能确定心肌收缩力的改变与本品有因果关系。对于有已知心血管风险及存在可能影响 LVEF 情况的患者,需要考虑监测心脏功能,包括在基线和服药期间测定 LVEF 功能。对于本品治疗期间出现心脏事件相关症状和体征的患者,需要考虑心脏监测包括 LVEF 功能测定。
对驾驶及操纵机器能力的影响
本品对驾驶和操作机器能力无影响或影响轻微。
【孕妇及哺乳期妇女用药】
男女性避孕
育龄期女性服用本品期间应避免妊娠。此类患者在完成本品治疗后的下列时间内仍应使用有效的避孕措施:女性至少2月,男性至少4个月。合并服用本品后,不能排除激素类避孕药暴露量下降的风险。
妊娠
目前还没有妊娠女性使用本品的数据,或数据非常有限。动物研究提示本品具有生殖毒性(致胚胎死亡、胚胎生长迟缓、新生胎仔死亡,见【药理毒理】)。根据作用机制及临床前数据,妊娠女性使用本品时可能对胎儿造成危害。除非患者的临床情况需要采用本品治疗,否则妊娠期间不得使用本品。
哺乳
目前尚不明确本品或其代谢产物是否会通过人的乳汁排泄。此外,目前也没有充分的信息表明本品或其代谢产物会经动物的乳汁排泄。然而,受乳的胎仔体内检出了本品及其代谢产物,而且对胎仔的生长和存活也产生了不良影响(见【药理毒理】)。因此无法排除本品对受乳的婴儿会产生影响。因此,采用本品治疗期间应停止哺乳。
生育能力
目前尚没有有关本品对人体的生育能力产生影响的数据。动物研究的结果提
示,本品对雌性和雄性的生殖器官有影响,而且会损害生育能力(见【药理毒理】)。
【儿童用药】
年龄小于 18 周岁的儿童或青少年患者使用本品的安全性和有效性尚不明确。
目前还没有这方面的数据。
【老年用药】
临床试验中,411 例患者中 187 例(45%)为 65 岁或 65 岁以上,54 例患者 (13%)为 75 岁和 75 岁以上。基于年龄,未观察到有效性存在总体差异。探索性分析显示,与小于 65 岁的患者相比,在 65 岁和 65 岁以上患者中 3 级和 4 级不良反应的发生率较高(32% vs 25%),因不良反应剂量调整更频繁(23% vs 17%)。
【药物相互作用】药代动力学相互作用
强效 CYP3A4 诱导剂可导致本品的暴露量下降。本品可能增加 BCRP 底物的暴露量。
可增加奥希替尼血浆浓度的活性物质
体外研究证实,本品主要通过 CYP3A4 和 CYP3A5 进行 I 期代谢。在临床药代动力学研究中,与 200mg 每日两次伊曲康唑(一种强效 CYP3A4 抑制剂)合并给药不会对本品的暴露量产生临床显著性影响(曲线下面积(AUC)增加 24%,Cmax下降了20%)。因此,CYP3A4 抑制剂不太可能对本品的暴露量产生影响。目前尚未确定其它对本品有催化作用的酶类。
可降低奥希替尼血浆浓度的活性物质
在临床药代动力学研究中,合并服用利福平(600mg 每日 1 次,共 21 天)会使本品的稳态 AUC 下降 78%。同样,代谢产物AZ5104 的暴露量也有所下降,其 AUC 和 Cmax分别下降了 82%和 78%。建议应避免同时使用本品和 CYP3A4 的强诱导剂(如苯妥英、利福平和卡马西平)。CYP3A4的中度诱导剂(如波生坦、依法韦仑、依曲