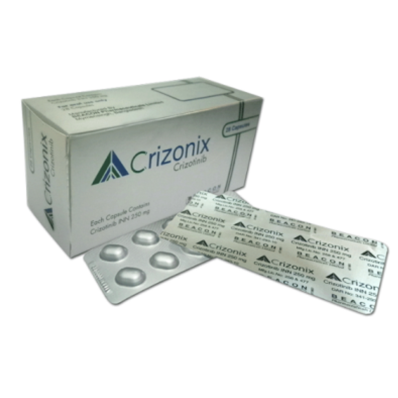


商品名: Crizonix 克唑替尼 赛可瑞
Goods name: Crizotinib Capsules CRIZALK
通用名: Crizonix 克唑替尼 CRIZALK 赛可瑞
Generic name: CRIZALK
制造商: 孟加拉国(Bengal)|Beacon
Manufacturer: (Bengal)|Beacon
形式: 28粒/盒 250mg
Form: 28 capsules / box 250mg
贮存: 常温
Keep in storage: homoeothermy
品牌(Brand): BEACON
积分(integral): 166
分销积分(distribution integral): 70
以下资料仅供参考
请仔细阅读说明书并在医师指导下使用:
克唑替尼使用说明书:
美国FDA初次批准:2011
【商品名称】
通用名称:克唑替尼
品牌名称: Crizonix
通用英文名称:Crizotinib
其他名称:XALKORI,赛可瑞 CRIZALK
【成分】
本品主要成分为克唑替尼
化学名:(R)-3- [1-(2,6-二氯-3-氟苯基)乙氧基] -5- [1-(哌啶-4-基)-1H-吡唑-4-基]吡啶-2-胺。
分子式:C21H22Cl2FN5O
分子量:450.34克/摩尔。
【适应症/功能主治】
克唑替尼是一种口服受体酪氨酸激酶抑制剂。适用于可用于经 FDA 批准的检测方法确定的变性淋巴瘤激酶(ALK)-阳性和ROS1阳性的局部晚期或转移非小细胞肺癌(NSCLC)患者的治疗。
【规格型号】250 mg*28粒/瓶
【用法用量]
克唑替尼胶囊的推荐剂量为 250mg 口服,每日两次,直至疾病进展或患者无法耐受。
对于无需透析的 严重肾损害(肌酐清除率<30ml/分钟)患者,克唑替尼胶囊的推荐剂量为 250 mg 口服,每日一次。
胶囊应整粒吞服。克唑替尼胶囊与食物同服或不同服均可。
若漏服一剂克唑替尼胶囊,则补服漏服剂量的 药物,除非距下次服药时间短于 6 小时。如果在服药后呕吐,则在正常时间服用下一剂药物。
剂量调整
如果患者出现美国国立癌症研究所(NCI)不良事件通用术语标准(CTCAE,第 4.0 版)规定的严重 程度为 3 级或 4 级的不良事件,需一次或多次减少剂量,按以下方法减少剂量:
第一次减少剂量:口服,200 mg,每日两次
第二次减少剂量:口服,250 mg,每日一次
如果每日一次口服 250 mg 克唑替尼胶囊仍无法耐受,则永久停服 剂量减少指南参见表 1 和表 2。
表 1. 克唑替尼胶囊剂量调整——血液学毒性
CTCAE 级别 3 级 暂停给药直至恢复至≤2 级或以下,继续服用同一剂量。
4 级 暂停给药直至恢复至≤2 级或以下,继续按下一个较低剂量给药
( 淋巴细胞减少除外(除非伴随临床事件,例如,机会性感染)。
表 2. 克唑替尼胶囊剂量调整——非血液学毒性
丙氨酸氨基转移酶(ALT)或天门冬氨 酸氨基转移酶(AST)升高大于正常值 上限(ULN)5 倍并伴有总胆红素小于 或等于正常值上限 1.5 倍 者 , 应暂停给药直至恢复至基线水平或者小于或等于正常值上限 3 倍,继续减少剂量给药
ALT 或 AST 升高大于正常值上限 3 倍, 同时总胆红素升高大于正常值上限 1.5 倍(未出现胆汁淤积或溶血)者应 永久停用本药
任何级别的药物相关间质性肺病/非感 染性肺炎 应永久停用本药
至少 2 个单独的 ECG 上 QTc 大于 500 ms 暂停给药直至基线水平或 QTc 小于 481 ms,继续减少剂量给 药
QTc 大于 500 ms 或与基线相比的变化 大于或等于 60 ms,并伴有尖端扭转型 室速、多形性室性心动过速或严重心律 失常的症状/体征者 应永久停用本药
心动过缓 a:(有症状、可能严重、具有 医学意义、需要医疗干预)者 应暂停用药,直到恢复为无症状性心动过缓或心率为 60 bpm 或 以上。并 评估已知会引起心动过缓的合并用药以及降压药物 如果确定并停用了导致心动过缓的合并用药或调整了其剂量, 继续服用先前恢复为无症状性心动过缓或心率为 60bpm 或以 上时的剂量 。如果确定没有引起心动过缓的合并用药,或未停用或调整引起 心动过缓的合并用药,继续减少剂量给药直至恢复为无症状性 心动过缓或心率为 60 bpm 或以上
心动过缓 a,b(危及生命、需要紧急干预): 如果确定没有引起心动过缓的合并用药,则永久停用本药 如果确定并停用了引起心动过缓的合并用药或调整了其剂量, 在恢复为无症状性心动过缓或心率为 60 bpm 或以上时,可在 频繁监测下继续用药 250 mg,每日一次
备注:a) 心率低于 60 次/分(bpm)。 b) 如果再次出现,永久停用。
应在每月和出现临床症状时监测包括白细胞分类计数的全血细胞计数,如果出现 3 或 4 级异常或发热 或感染时,应增加监测频度。
肝损害患者
目前尚未对肝损害的患者使用克唑替尼的情况进行研究。由于克唑替尼主要在肝脏代谢,肝损害很可 能升高克唑替尼的血浆浓度。因此,肝损害的患者使用克唑替尼胶囊进行治疗时应谨慎。
肾损害患者
根据群体药代动力学分析,对轻度(肌酐清除率[CLcr]为 60 至 89 ml /分钟)和中度([CLcr]为 30 至 59ml/分钟)肾损害的患者不需要进行起始剂量调整。在无需透析的严重肾损伤([CLcr]小于 30ml/分钟) 患者中,克唑替尼的暴露量增加,推荐克唑替尼起始剂量为 250 mg,口服,每日一次。
【不良反应】
肝毒性[见注意事项]。
间质性肺病/非感染性肺炎[见注意事项]
QT 间期延长[见注意事项]
心动过缓[见注意事项]
克唑替尼胶囊最常见的不良反应(≥25%)为视觉异常、恶心、腹泻、呕吐、便秘、水肿、转氨酶升高 及疲乏。
特定药物不良反应描述
视觉异常
神经病变
肾囊肿
【禁忌】 禁用于对克唑替尼或本品中任一成分过敏的患者。禁用于严重肝损害患者。
【注意事项】
肝毒性
间质性肺病(非感染性肺炎)
一旦患者出现治疗相关的 ILD/非感染性肺炎,应永久停止克唑替尼的治疗。
QT间期延长
心动过缓
胚胎毒性
根据克唑替尼胶囊的作用机制,妊娠妇女服用后可能会给胎儿带来伤害。
若在妊娠期间服用克唑替尼胶囊, 或患者在服药期间怀孕,则应告知其该药对胎儿的潜在危害
【孕妇及哺乳期妇女用药】
孕妇
基于克唑替尼胶囊的作用机制,妊娠妇女服用可能会给胎儿带来伤害。目前尚无对妊娠妇女服用克唑 替尼胶囊进行足够的且良好对照的研究。
育龄妇女在服用克唑替尼胶囊进行治疗时应尽量避免怀孕。
服用本药的育龄妇女或服用本药的育龄妇女的伴侣,在治疗过程中以及完成治疗至少 90 天内应采取适 当的方法进行避孕。
若在妊娠期间服用本药,或患者或其伴侣在用药期间怀孕,则应告知其本品对胎 儿具有潜在危害。
哺乳期妇女
目前尚不明确克唑替尼及其代谢物是否会从乳汁中分泌。由于多数药物通常都会从乳汁中分泌,以及 婴儿若暴露于克唑替尼会发生潜在的严重不良反应,因此,决定哺乳期妇女是否终止哺乳或停止用药 非常重要。
【儿童用药】
目前尚无儿科患者使用克唑替尼胶囊的有效性和安全性数据。
【老年用药】
未见这些患者与年轻患者在安全性或有效性方面存在总体差异。
【药物相互作用】
可能会增加克唑替尼血药浓度的药物
克唑替尼与 CYP3A 强抑制剂合用可能会导致克唑替尼血药浓度升高(参见【药代动力学】)。应避免 合并使用下列 CYP3A 强抑制剂(包括但不仅限于):阿扎那韦、克拉霉素、印地那韦、伊曲康唑、酮 康唑、奈法唑酮、奈非那韦、利托那韦、沙奎那韦、克拉霉素、泰利霉素、醋竹桃霉素和伏立康唑。 而西柚或西柚汁也可能会增加克唑替尼的血药浓度,应避免同时食用。与中度 CYP3A 抑制剂合并用药 时应谨慎。
可能会降低克唑替尼血药浓度的药物
克唑替尼与 CYP3A 强诱导剂合用可能会导致克唑替尼血药浓度降低(参见【药代动力学】)。应避免 合并使用下列 CYP3A 强诱导剂(包括但不仅限于):卡马西平、苯巴比妥、苯妥英钠、利福平、利福 布丁和圣约翰草。
克唑替尼可能改变其血药浓度的药物
克唑替尼在体内或体外均可抑制 CYP3A(参见【药代动力学】)。
服用克唑替尼的患者应避免与治疗 指数较窄的 CYP3A 底物(包括但不限于阿芬太尼、环孢霉素、双氢麦角胺、麦角胺、芬太尼、匹莫齐 特、奎尼丁、西罗莫司和他克莫司)合并使用。如果服用克唑替尼胶囊的患者需要合并使用这些治疗 指数较窄的 CYP3A 底物,可能需要减少 CYP3A 底物的剂量,因为药物合用可产生不良反应。
【药物过量】
目前尚无已知的克唑替尼胶囊药物过量的病例。目前尚无克唑替尼胶囊解毒剂。
【药理作用】
克唑替尼是一种酪氨酸激酶受体抑制剂,包括 ALK、肝细胞生长因子受体(HGFR,c-Met)、ROS1(c-cos) 和 RON。易位可促使 ALK 基因引起致癌融合蛋白的表达。ALK 融合蛋白形成可引起基因表达和信号 的激活和失调,进而促使表达这些蛋白的肿瘤细胞增殖和存活。克唑替尼在肿瘤细胞株中对 ALK、ROS1 和 c-Met 在细胞水平检测的磷酸化具有浓度依赖性抑制作用,对表达 EML4-ALK 或 NPM-ALK 融合蛋 白或 c-Met 的异种移植荷瘤小鼠具有抗肿瘤活性。
【药代动力学】
吸收
口服单剂量克唑替尼,平均 4~6 小时克唑替尼的吸收达到峰值。每日服用 250mg 克唑替尼两次,15 天 内可达到并保持稳态血药浓度,平均累积率为 4.8。当剂量超出每日两次、每次 200~300 mg 的剂量范 围,稳态系统药物暴露(Cmin和 AUC)的增加略高于剂量的增加比例。 单剂量口服给药 250mg 后,克唑替尼的平均绝对生物利用度为 43%(范围:32%~66%)。 高脂膳食可使克唑替尼的 AUCinf和 Cmax降低约 14%。克唑替尼与食物同服或不同服均可。(参见【用 法用量】)。
分布
静脉注射 50mg 克唑替尼,药物几何平均分布容积(Vss)为 1772 升,说明药物自血浆广泛分布至组 织内。 在体外克唑替尼与人体血浆蛋白结合率为 91%,与药物浓度无关。体外研究表明克唑替尼为 P-糖蛋白 (P-gp)的底物。血液-血浆浓度比率约为 1。
代谢
参与克唑替尼代谢消除的主要酶是 CYP3A4/5。克唑替尼在人体的主要代谢途径是哌啶环氧化得到克唑 替尼酰胺和 O-脱羟产物,并在随后的第二步中 O-脱羟产物形成共轭。
清除
克唑替尼单剂量给药后,表观终末半衰期为 42 小时。 健康志愿者在服用单剂量 250mg 放射物标记的克唑替尼后,在其粪便和尿液中分别发现给药剂量 63% 和 22%的放射物标记的克唑替尼。粪便与尿液中克唑替尼原型药物分别约占给药剂量 53%和 2.3%。 克唑替尼 250mg 每日两次给药后在稳态时的平均表观清除率(CL/F)(60 升/小时)低于单剂量 250mg 口服给药后的(100 升/小时),可能归因于克唑替尼多次给药后 CYP3A 的自动抑制。
药物相互作用
CYP3A 抑制剂
克唑替尼单剂量口服 150mg,合并 CYP3A 强抑制剂酮康唑(200mg,每日两次),克唑替尼的 AUCinf 和 Cmax值与单独服用克唑替尼相比,分别增加约 3.2 倍和 1.4 倍。但是目前尚未确立 CYP3A 抑制剂对 稳态克唑替尼暴露量影响的大小 (参见【药物相互作用】)。
CYP3A 诱导剂
克唑替尼单剂量口服 250mg,合并服用 CYP3A 强诱导剂利福平(600mg,每日一次),克唑替尼的 AUCinf和 Cmax与单独服用克唑替尼相比分别降低 82%和 69%。但是尚未确立 CYP3A 诱导剂对于稳态 克唑替尼暴露量的影响的大小 (参见【药物相互作用】)。
提高胃内 PH 值的药物:在正常受试者中,连续 5 日每日服用埃索美拉唑 40 mg 后,同时单剂量口服 250 mg 克唑替尼,未发现克唑替尼暴露量出现临床相关变化(AUCinf降低 10%,Cmax无变化)。
CYP3A 底物:合用咪达唑仑与克唑替尼(每日两次,每次 250 mg,连续服用 28 天)的患者的 AUCinf 与单独口服咪达唑仑时相比增加了 3.7 倍,这表明克唑替尼是 CYP3A 的一种中度抑制剂(参加【药物 相互作用】)。
其他 CYP 底物
体外研究表明,尽管克唑替尼是 CYP1A2,CYP2C8,CYP2C9,CYP2C19 或 CYP2D6 等底物代谢的介 导抑制剂,但在临床上不会发生药物相互作用。 克唑替尼是 CYP2B6 的体外抑制剂。因此,克唑替尼与主要经 CYP2B6 代谢的药物合并使用时可能会 增加其血药浓度。 体外研究表明,尽管克唑替尼是 CYP1A2,CYP2B6,CYP2C8,CYP2C9,CYP2C19 或 CYP3A 底物代 谢的介导诱导剂,但在临床上不会发生药物相互作用。
UGT 底物
体外研究表明,尽管克唑替尼介导抑制属于UGT1A1、UGT1A4、UGT1A6、UGT1A9或UGT2B7底物 的药物代谢,但在临床上不会发生药物相互作用。
转运底物
在体外,临床相关浓度的克唑替尼会抑制 P-糖蛋白(P-gp)。因此,当克唑替尼与属于 P-糖蛋白底物 的药物合并使用时可能增加其血药浓度。
体外研究表明,临床相关浓度的克唑替尼会抑制肝脏摄取转运蛋白、有机阳离子转运蛋白 1(OCT1)、 肾脏摄取转运蛋白和有机阳离子转运蛋白 2(OCT2)。因此,当克唑替尼与属于 OCT1 或 OCT2 底物 的药物合并使用时可能增加其血药浓度。体外研究发现,临床相关浓度的克唑替尼不会抑制人类肝脏摄取转运蛋白 OATP1B1 或 OATP1B3 或者 肾脏摄取转运蛋白 OAT1 或 OAT3。
对其他转运蛋白的作用
体外研究表明,临床相关浓度的克唑替尼不会抑制肝脏外排胆盐输出泵转运蛋白(BSEP)。
【贮藏】
应在25°C以下;外出允许至15°-30°C。